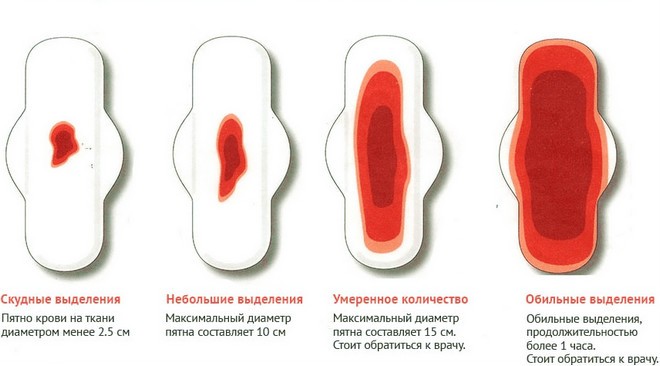
Тянет низ живота от дюфастона: Дюфастон и боли внизу живота — 21 ответов
Содержание
Как вылечить эндометриоз с помощью Дюфастона. Побочные реакции при лечении эндометриоза Дюфастоном
Эндометриоз – патология, которая характеризуется разрастанием ткани, имеющей сходство с эндометрием и подвергающейся циклическим изменениям. Эндометриоидные очаги могут располагаться на любых органах, чаще всего поражая тело матки, придатки, кишечник, брюшину, мочевой пузырь и почки. С терапевтической целью специалисты назначают различные лекарственные препараты. На раннем этапе очень часто используют для лечения эндометриоза Дюфастон. Ведь он обладает выраженным эффектом, вызывая минимум побочных реакций.
Лечение эндометриоза и дюфастон
Нарушения работы эндокринной системы отражаются на состоянии всего организма, в частности функциональности половой системы. При недостаточном количестве прогестерона и избытке эстрогенов эндометрий (внутренняя оболочка полости матки) начинает активно разрастаться. Так как эндометриоидные очаги также подвержены циклическим изменениям, то на них также отражается гормональный дисбаланс, что приводит к чрезмерному разрастанию патологических очагов и распространению заболевания.
Сегодня наиболее эффективным способом лечения эндометриоза является сочетание хирургических и консервативных методик. Максимальный результат в запущенных случаях дают медикаменты, вводящие женщин в искусственную менопаузу и подавляющие активность яичников. После терапии все функции полностью восстанавливаются, но существуют определенные риски и последствия. На ранних этапах возможно лечение эндометриоза Дюфастоном, этот препарат оказывает мягкое действие и способствует восстановлению баланса гормонов. К тому же он полностью сохраняет репродуктивную функцию у женщин и не препятствует беременности. Стоит отметить, что прием препарата сохраняют даже после успешного зачатия, чтобы снизить риски выкидыша.
Показания и противопоказания Дюфастона
Препарат активно используют в гинекологической практике при недостатке прогестерона, в том числе используют Дюфастон для лечения эндометриоза. Помимо этого, он показан при бесплодии, нарушениях менструальной функции, аменорее, дисфункциональных маточных кровотечениях, заместительной гормонотерапии во время климакса.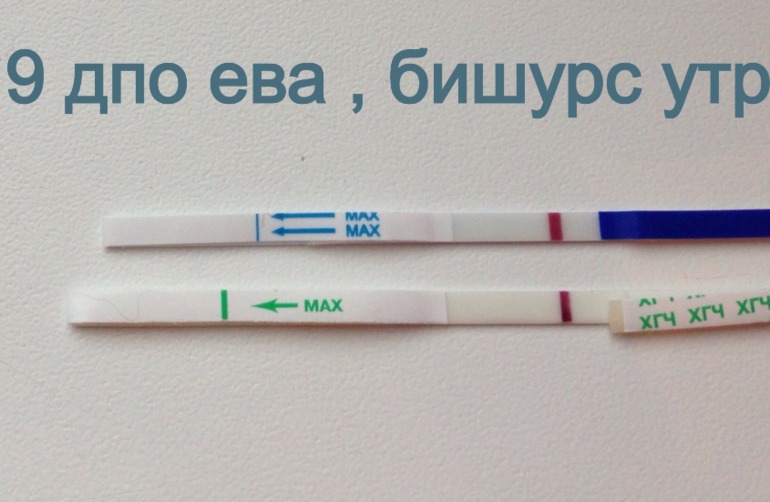
Противопоказанием для применения препарата служит непереносимость его компонентов и аллергические реакции. Также Дюфастон следует использовать с осторожностью в лактационный период, так как он проникает в грудное молоко.
В любом случае медикаментозные препараты должны назначаться врачом после тщательного обследования. Самостоятельный прием лекарственных средств может навредить организму и вызвать неблагоприятные реакции. Получить подробную информацию о препарате и пройти полноценное обследование можно в клинике «Центр ЭКО» Курск.
Дюфастон и его эффекты при лечении эндометриоза
Основное действующее вещество препарата – дидрогестерон – аналог природного прогестерона. В 1 таблетке Дюфастона содержится 10 мг активного компонента. Попадая в организм, он быстро всасывается в кровь, его максимальная концентрация наблюдается через 2 часа. Дидрогестерон, избирательно связываясь с прогестероновыми рецепторами в матке, способствует переходу эндометрия из фазы пролиферации в период секреции, предотвращая его избыточное разрастание. К тому же Дюфастон, как и прогестерон, готовит слизистую оболочку к возможной беременности и имплантации зародыша, снижает возбудимость мышечного слоя матки и уменьшает его сократительную деятельность.
К тому же Дюфастон, как и прогестерон, готовит слизистую оболочку к возможной беременности и имплантации зародыша, снижает возбудимость мышечного слоя матки и уменьшает его сократительную деятельность.
Стоит отметить, что дидрогестерон не является производным тестостерона, поэтому при лечении эндометриоза Дюфастоном исключается андрогенная и анаболическая активность, маскулинизирующий эффект, нарушения дифференцировки и развития плода, изменения температуры тела. Препарат не меняет обмен веществ, поэтому пациентки могут не опасаться набора веса.
К тому же Дюфастон снижает воздействие эстрогенов на женский организм, следовательно, может активно применятся при бесплодии и частых выкидышах, маточных кровотечениях и других патологических состояниях, вызванных избытком эстрогенов. В то же время он не подавляет положительных эффектов этих гормонов, которые предотвращают формирование сердечно-сосудистых и нервных заболеваний.
В целом можно выделить следующие положительные эффекты Дюфастона при лечении эндометриоза:
- Подавление роста эндометриоидной ткани;
- Сохранение овуляции;
- Снижение или полное устранение межменструальных и маточных кровотечений;
- Уменьшение сократительной деятельности матки и, как следствие, купирование боли;
- Предупреждение рецидивов заболевания после оперативного вмешательства;
- Предотвращение перерождения эндометриоидных очагов в онкологические новообразования.

Способы применения препарата Дюфастон
Существуют определенные схемы лечения препаратом в зависимости от диагноза и прогнозируемого эффекта, но в любом случае дозировка и курс терапии подбирается в индивидуальном порядке. При лечении Дюфастоном эндометриоза врач учитывает степень распространения процесса, запущенность патологии, состояние здоровья пациентки.
Как правило, Дюфастон во время лечения эндометриоза принимают по 1 таблетке 2-3 раза в сутки независимо от приема пищи. Начинать терапию рекомендуется на 5 день менструального цикла до 25, но иногда врачи рекомендуют приступить к лечению на следующий день после овуляции, чтобы не препятствовать успешному зачатию. При регулярном 28 дневном цикле овуляция наступает примерно на 12-14 день, овуляторный период можно вычислить по уровню базальной температуры, концентрации гормонов, УЗИ или при помощи специальных тестов. Курс лечения длительный, в большинстве случаев продолжается 9 месяцев и более. После наступления беременности не стоит сразу отменять препарат, срок его применения корректируется врачом.
Побочные реакции при лечении эндометриоза Дюфастоном
Дюфастон – гормональный препарат, поэтому перед его назначением следует пройти полноценное обследование. В частности необходимо выявить наличие прогестерон — зависимой опухоли, ведь Дюфастон может спровоцировать ее рост и распространение.
Все лекарственные средства могут вызвать побочные проявления, поэтому не исключаются негативные реакции Дюфастона при лечении эндометриоза. Чаще всего пациенты жалуются на головные боли, маточные кровотечения, увеличение чувствительности молочных желез, слабость, общее недомогание, изменение функциональности печени, желтушность кожных покровов, сыпь, периферические отеки, анемию.
При лечении эндометриоза Дюфастоном следует учитывать его взаимодействие с другими лекарственными препаратами. В целом он совместим с медикаментами, но некоторые средства, в частности индукторы ферментов печени, могут усиливать метаболизм Дюфастона и снижать его эффективность.
Терапия угрозы прерывания беременности в I триместре | Зайдиева З.
 С., Магометханова Д.М.
С., Магометханова Д.М.
Этиологическая структура различных гестационных осложнений, в том числе и прерывания беременности на ранних сроках, разнообразна [1,4,5,7,8]. Причинно–следственные механизмы, обусловливающие развитие патологии в каждом отдельном случае при наличии прочих равных условий до настоящего времени остаются в стадии изучения. I триместр беременности является наиболее значимым, поскольку в этот период происходит эмбриогенез, формирование плаценты и сложных взаимоотношений между матерью и плодом. Угроза прерывания беременности в I триместре часто осложняет нормальное течение этих процессов, что может приводить к спонтанным абортам, развитию плацентарной недостаточности, внутриутробному страданию плода [3,5,12]. Несмотря на большое количество научных исследований [1,2,3,6,8], посвященных данной проблеме, до настоящего времени вопросы, посвященные ведению данного контингента беременных, особенно на первых, самых ответственных этапах гестации, остаются до конца не решенными.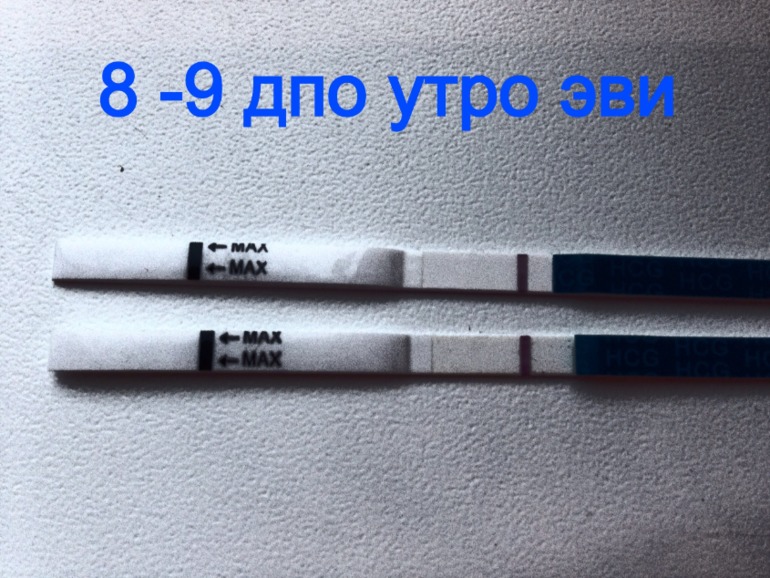
На сегодняшнем этапе научного поиска многие исследователи приходят к выводу о тесной взаимосвязи и взаиморегуляции между эндокринной и иммунной системами на ранних этапах имплантации [4,5,8,10,11,12]. Неоспорим тот факт, что прогестерон играет очень важную роль в организме женщины. Еще до наступления беременности он вызывает децидуальную трансформацию эндометрия, подготавливая его к имплантации оплодотворенной яйцеклетки, а в период гестации способствует росту и васкуляризации миометрия, снижает возбудимость матки путем нейтрализации действия окситоцина, подавляет тканевые иммунологические реакции и др. [1,5,6,13]. Доказано, что прогестерон способствует полноценной секреторной трансформации эндометрия, необходимой для внедрения бластоцисты. Кроме того, во время беременности гестагены обеспечивают рост и развитие миометрия, его васкуляризацию и релаксацию путем нивелирования влияния окситоцина и снижения синтеза простагландинов [3,7,8,14].
Осложнения на начальных этапах гестации могут быть следствием как неполноценного стероидогенеза, так и недостаточности рецепторного аппарата эндометрия. Для успешной имплантации эмбриона необходимо согласование во времени готовности эндометрия к имплантации с развитием эмбриона (так называемое «имплантационное окно») [3,6,8]. В подобных ситуациях терапевтический подход должен учитывать этиологию формирования неполноценной лютеиновой фазы и нивелировать неблагоприятные предрасполагающие факторы. При хроническом воспалительном процессе в матке и придатках, помимо назначения индивидуально подобранной этиологической терапии, иммуномодулирующей терапии, необходима коррекция гормонального фона, что позволяет нормализовать состояние эндометрия и обеспечить адекватный бластогенез и плацентацию.
Для успешной имплантации эмбриона необходимо согласование во времени готовности эндометрия к имплантации с развитием эмбриона (так называемое «имплантационное окно») [3,6,8]. В подобных ситуациях терапевтический подход должен учитывать этиологию формирования неполноценной лютеиновой фазы и нивелировать неблагоприятные предрасполагающие факторы. При хроническом воспалительном процессе в матке и придатках, помимо назначения индивидуально подобранной этиологической терапии, иммуномодулирующей терапии, необходима коррекция гормонального фона, что позволяет нормализовать состояние эндометрия и обеспечить адекватный бластогенез и плацентацию.
Принципиальную роль в подготовке слизистой оболочки матки к имплантации играет прогестерон. Общепризнано, что для нормального исхода беременности иммунная система женщины должна распознать ее. При нормально протекающей беременности в лимфоцитах периферической крови присутствуют рецепторы прогестерона, причем доля клеток, содержащих такие рецепторы, возрастает по мере увеличения срока гестации. В случае угрозы прерывания беременности доля клеток, содержащих рецепторы прогестерона, существенно ниже, чем у здоровых женщин, находящихся на том же сроке беременности. Ряд ученых полагают, что увеличение числа рецепторов прогестерона при беременности может быть вызвано присутствием эмбриона, который выступает в роли хорионического аллоантигенного (чужеродного) стимулятора [6,9,11].
В случае угрозы прерывания беременности доля клеток, содержащих рецепторы прогестерона, существенно ниже, чем у здоровых женщин, находящихся на том же сроке беременности. Ряд ученых полагают, что увеличение числа рецепторов прогестерона при беременности может быть вызвано присутствием эмбриона, который выступает в роли хорионического аллоантигенного (чужеродного) стимулятора [6,9,11].
По мнению A.R. Genazzani [10], около 15% всех наступивших беременностей завершается самопроизвольным абортом, который является одним из наиболее частых осложнений беременности. По данным статистики, примерно у одной из четырех беременных женщин возникают один и более самопроизвольных выкидыша.
О привычном невынашивании говорят в случае, если имели место три и более повторных самопроизвольных выкидыша. Данная патология, по данным В.М. Сидельниковой [5], встречается примерно у 1–3% всех женщин. При этом риск невынашивания беременности после трех повторных самопроизвольных выкидышей достигает 55%.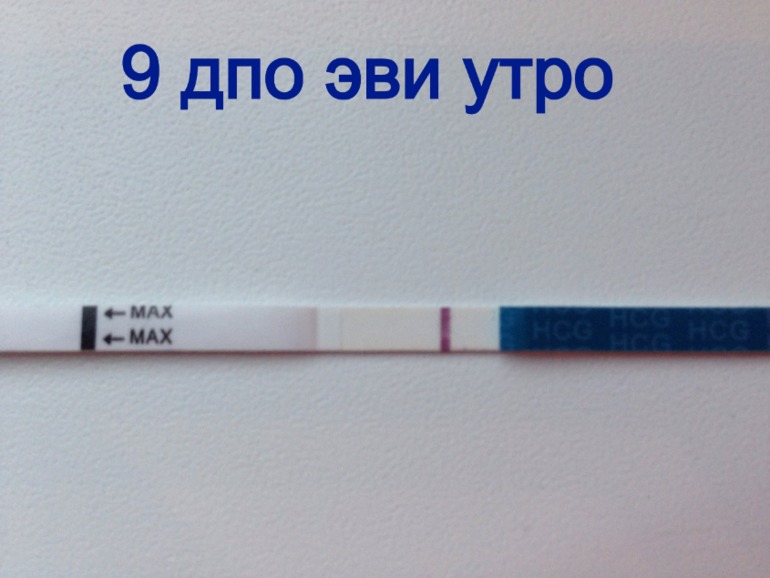 В большинстве случаев (50–60%) причиной выкидышей являются гормональные нарушения, структурные аномалии хромосом зародыша, инфекции, эндокринные расстройства, анатомические дефекты у матери и др. Многие исследователи [1,3,5,7,14] полагают, что большая часть выкидышей, имеющих неясную этиологию, может быть вызвана ненормальной иммунной реакцией организма матери на отцовские антигены зародыша. В настоящее время появляется все больше данных, свидетельствующих о том, что прогестерон, по–видимому, играет важную роль в нормализации иммунного ответа на ранних стадиях беременности. При нормально протекающей беременности желтое тело, а позже плацента вырабатывают достаточное количество прогестерона. В его присутствии активируемые лимфоциты вырабатывают специальный белок – прогестерон–индуцированный блокирующий фактор (ПИБФ), который оказывает антиабортивное действие.
В большинстве случаев (50–60%) причиной выкидышей являются гормональные нарушения, структурные аномалии хромосом зародыша, инфекции, эндокринные расстройства, анатомические дефекты у матери и др. Многие исследователи [1,3,5,7,14] полагают, что большая часть выкидышей, имеющих неясную этиологию, может быть вызвана ненормальной иммунной реакцией организма матери на отцовские антигены зародыша. В настоящее время появляется все больше данных, свидетельствующих о том, что прогестерон, по–видимому, играет важную роль в нормализации иммунного ответа на ранних стадиях беременности. При нормально протекающей беременности желтое тело, а позже плацента вырабатывают достаточное количество прогестерона. В его присутствии активируемые лимфоциты вырабатывают специальный белок – прогестерон–индуцированный блокирующий фактор (ПИБФ), который оказывает антиабортивное действие.
Как известно, при сохранении беременности на фоне лютеиновой недостаточности в дальнейшем формируется первичная плацентарная недостаточность. Для ее профилактики необходима полноценная подготовка к беременности и правильное ведение пациенток с угрожающим и привычным невынашиванием.
Для ее профилактики необходима полноценная подготовка к беременности и правильное ведение пациенток с угрожающим и привычным невынашиванием.
Для лечения угрожающего и привычного выкидыша практичным и высокоэффективным является прямое воздействие на рецепторы прогестерона за счет восполнения недостатка эндогенного прогестерона при помощи лекарственных средств – прогестагенов. Современным эффективным гестагенным препаратом является Дюфастон (дидрогестерон), в структуре которого метильная группа в позиции 10 расположена в a–позиции, водород при углероде 9 находится в b–позиции, кроме того, между углеводами 6 и 7 имеет место двойная связь. Изменение конфигурации молекулы приводит к тому, что Дюфастон легко абсорбируется при пероральном введении. Дидрогестерон в дозе 20–30 мг вызывает в эндометрии полноценную фазу секреции. Исследования, проведенные на животных, подтверждают высокую способность дидрогестерона поддерживать беременность.
Дюфастон является сильнодействующим гестагеном, эффективным при приеме внутрь, который по своей молекулярной структуре и фармакологическому действию близок к эндогенному прогестерону и вследствие этого обладает высокой аффинностью (сродством) к рецепторам прогестерона.
В отличие от многих прогестагенов он не является производным тестостерона, его структура отличается от структуры большинства синтетических прогестагенов, вследствие чего не вызывает ни одного из побочных эффектов, характерных для большинства этих препаратов.
Преимуществами химической структуры дидрогестерона является более высокая биодоступность препарата после перорального применения и отсутствие метаболитов с андрогенной или эстрогенной активностью. Основным метаболитом Дюфастона является 20 a–дигидроксидидрогестерон, который также обладает прогестагенной активностью.
Последние данные показали, что антиабортные эффекты прогестерона в течение ранней беременности вызваны также модуляцией материнского иммунного ответа. Доказано, что в присутствии Дюфастона активизированные лимфоциты синтезируют белок (блокирующий фактор, индуцированный прогестероном). Последний предотвращает воспалительные и вторичные тромботические реакции отторжения трофобласта за счет увеличения асимметричных нетоксичных блокирующих антител, а также блокады дегрануляции клеток естественных киллеров и за счет индукции T–лимфоцит–2 (Th3) зависящих цитокинов, перемещая баланс в сторону Th3 клеток, т.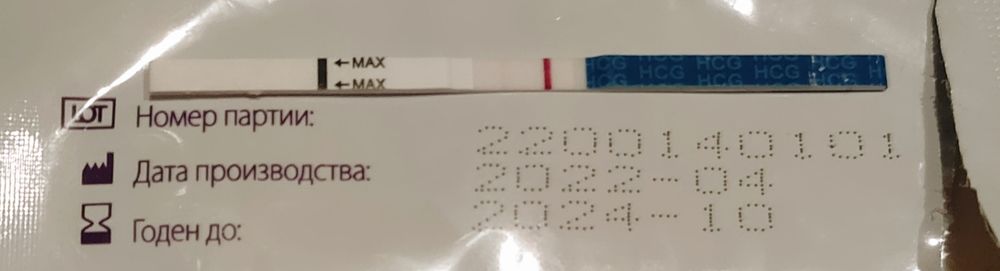 е. цитопротективного иммунного ответа [4,7]. Возмещая недостаточность лютеиновой фазы при угрозе или привычном прерывании беременности, Дюфастон оказывает также расслабляющий эффект на мускулатуру матки.
е. цитопротективного иммунного ответа [4,7]. Возмещая недостаточность лютеиновой фазы при угрозе или привычном прерывании беременности, Дюфастон оказывает также расслабляющий эффект на мускулатуру матки.
В отличие от других синтетических прогестагенов Дюфастон не вызывает феминизации плода мужского пола и не оказывает побочного действия на функции печени и свертываемость крови, таких проявлений, как угревые высыпания, огрубение голоса, гирсутизм и маскулинизации половых органов плода женского пола, не имеет метаболических эффектов (например, изменения липидного спектра крови и концентрации глюкозы), а также не влияет на активность гипофизарно–яичниковой системы и не вызывает атрофии надпочечников.
Одна таблетка Дюфастона содержит 10 мг дидрогестерона. После перорального приема дигидрогестерона 63% введенной дозы элиминируется с мочой, причем 85% от этого количества выводится в течение 24 часов. Практически полная почечная экскреция введенной дозы заканчивается через 72 часа.
При угрожающем выкидыше в комплекс лечения рекомендуется включать прием 40 мг данного препарата одномоментно, затем по 10 мг каждые 8 ч до исчезновения симптомов прерывания беременности. При привычном выкидыше назначают 10 мг Дюфастона 2 раза в сутки до 18–20–й недели беременности.
Появляется все большее количество данных в пользу того, что иммуномодулирующее действие гормонов имеет важное значение для поддержания нормальной функции эндометрия. Результаты исследований, проведенных A.R. Genazzani [10], показывают роль иммунной системы при беременности и, в частности, увеличение количества рецепторов прогестерона на лимфоцитах по мере развития беременности. В присутствии прогестерона или его аналога Дюфастона лимфоциты вырабатывают прогестерон–индуцированный блокирующий фактор. В результате иммунологических эффектов ПИБФ увеличивается активность Т–хелперных клеток II типа (Тh3), способствующих нормальному протеканию беременности, и снижается активность Т–хелперных клеток I типа (ТМ), оказывающих неблагоприятное действие на беременность. Авторы показали, что дидрогестерон (Дюфастон) также способен сместить соотношение Тh3/Th2 в благоприятную сторону и тем самым повысить вероятность успешной беременности. Этот эффект был подтвержден в двух клинических исследованиях, показавших, что дидрогестерон снижает частоту самопроизвольных абортов у женщин с угрозой выкидыша или привычным выкидышем в анамнезе.
Авторы показали, что дидрогестерон (Дюфастон) также способен сместить соотношение Тh3/Th2 в благоприятную сторону и тем самым повысить вероятность успешной беременности. Этот эффект был подтвержден в двух клинических исследованиях, показавших, что дидрогестерон снижает частоту самопроизвольных абортов у женщин с угрозой выкидыша или привычным выкидышем в анамнезе.
Углубленные исследования о роли ПИБФ в поддержании беременности проводились J. Szekeres–Bartho и соавт. [13,14]. Общепризнано, что для нормального исхода беременности необходимо, чтобы иммунная система была способна ее распознать. При нормально протекающей беременности в лимфоцитах периферической крови присутствуют рецепторы прогестерона, причем доля клеток, содержащих такие рецепторы, увеличивается по мере увеличения срока гестации. Однако у женщин с высоким риском преждевременного прекращения беременности доля клеток, содержащих рецепторы прогестерона, существенно ниже, чем у здоровых женщин, находящихся на том же сроке беременности. После пересадки трансплантата или переливания крови количество клеток, содержащих рецепторы прогестерона, сравнимо с аналогичным показателем у беременных женщин. Это позволяет предположить, что у беременных увеличение числа рецепторов прогестерона на лимфоцитах может быть вызвано присутствием зародыша, который выступает в роли аллоантигенного стимулятора. В присутствии прогестерона эти лимфоциты продуцируют особый медиаторный белок 34–kD, или ПИБФ. Концентрация ПИБФ растет по мере увеличения срока гестации, но исчезает по истечении 40 недель при нормально протекающей беременности. Благодаря иммунологическому влиянию ПИБФ сохраняется беременность. ПИБФ изменяет баланс цитокинов в иммунной системе. При этом существуют два типа цитокинов: цитокины, вырабатываемые Т–хелперными клетками Th2, которые оказывают неблагоприятное действие на беременность, и цитокины, вырабатываемые Т–хелперными клетками Тh3, которые способствуют нормальному течению беременности. В присутствии ПИБФ происходит сдвиг в сторону преобладания цитокинов Тh3.
После пересадки трансплантата или переливания крови количество клеток, содержащих рецепторы прогестерона, сравнимо с аналогичным показателем у беременных женщин. Это позволяет предположить, что у беременных увеличение числа рецепторов прогестерона на лимфоцитах может быть вызвано присутствием зародыша, который выступает в роли аллоантигенного стимулятора. В присутствии прогестерона эти лимфоциты продуцируют особый медиаторный белок 34–kD, или ПИБФ. Концентрация ПИБФ растет по мере увеличения срока гестации, но исчезает по истечении 40 недель при нормально протекающей беременности. Благодаря иммунологическому влиянию ПИБФ сохраняется беременность. ПИБФ изменяет баланс цитокинов в иммунной системе. При этом существуют два типа цитокинов: цитокины, вырабатываемые Т–хелперными клетками Th2, которые оказывают неблагоприятное действие на беременность, и цитокины, вырабатываемые Т–хелперными клетками Тh3, которые способствуют нормальному течению беременности. В присутствии ПИБФ происходит сдвиг в сторону преобладания цитокинов Тh3. Одновременное уменьшение выработки цитокинов Тh2 влечет за собой снижение активности естественных киллерных клеток (ЕКК) и нормальному исходу беременности. На фоне приема Дюфастона происходит достоверное повышение концентрации ПИБФ–позитивных лимфоцитов, что влечет за собой вышеописанные изменения в иммунной системе, направленные на сохранение беременности. В случаях же отсутствия ПИБФ концентрация цитокинов ТМ повышается и одновременно активизируются естественные киллерные клетки, что повышает вероятность аборта.
Одновременное уменьшение выработки цитокинов Тh2 влечет за собой снижение активности естественных киллерных клеток (ЕКК) и нормальному исходу беременности. На фоне приема Дюфастона происходит достоверное повышение концентрации ПИБФ–позитивных лимфоцитов, что влечет за собой вышеописанные изменения в иммунной системе, направленные на сохранение беременности. В случаях же отсутствия ПИБФ концентрация цитокинов ТМ повышается и одновременно активизируются естественные киллерные клетки, что повышает вероятность аборта.
При угрозе выкидыша или преждевременных родах уровень ПИБФ значительно ниже, чем при нормально протекающей беременности. При недостатке ПИБФ активность естественных киллерных клеток возрастает примерно в 4 раза. В настоящее время считается, что повышенная активность ЕКК является одним из факторов, обусловливающих досрочное прекращение беременности.
M.Y. El–Zibdeh [9] публикует данные о результатах двух исследований, целью которых было выяснить, возможно ли с помощью дидрогестерона улучшить исход беременности у женщин, страдающих привычным выкидышем. 114 женщин с привычным выкидышем в анамнезе (среднее количество предыдущих выкидышей 3,3) были методом случайной выборки разделены на три группы и получали: дидрогестерон (Дюфастон) внутрь по 10 мг два раза в сутки; или хорионический гонадотропин человека (ХГЧ) внутримышечно по 5000 ME каждые 4 дня; или не получали никакого лечения. Терапию начинали сразу после подтверждения наступления беременности и прекращали при сроке гестации 12 недель. В группе женщин, принимавших Дюфастон, частота абортов достоверно (р<0,05) снизилась по сравнению с контрольной группой на 27%, в группе ХГЧ – на 16,6% (р<0,05). В группе принимавших Дюфастон частота абортов составила 14,6%, в группе ХГЧ – 16,6%, в контрольной группе – 20%. Дюфастон хорошо переносился пациентками. Частота осложнений беременности была примерно одинаковой во всех трех группах.
114 женщин с привычным выкидышем в анамнезе (среднее количество предыдущих выкидышей 3,3) были методом случайной выборки разделены на три группы и получали: дидрогестерон (Дюфастон) внутрь по 10 мг два раза в сутки; или хорионический гонадотропин человека (ХГЧ) внутримышечно по 5000 ME каждые 4 дня; или не получали никакого лечения. Терапию начинали сразу после подтверждения наступления беременности и прекращали при сроке гестации 12 недель. В группе женщин, принимавших Дюфастон, частота абортов достоверно (р<0,05) снизилась по сравнению с контрольной группой на 27%, в группе ХГЧ – на 16,6% (р<0,05). В группе принимавших Дюфастон частота абортов составила 14,6%, в группе ХГЧ – 16,6%, в контрольной группе – 20%. Дюфастон хорошо переносился пациентками. Частота осложнений беременности была примерно одинаковой во всех трех группах.
В другом исследовании M.Y. El–Zibdeh [9] изучал эффективность препарата Дюфастон при начавшемся выкидыше. Кровотечение на ранних сроках беременности является распространенным явлением и отмечается в 30–50% всех беременностей. По мнению автора, до начала лечения следует установить причину кровотечения. Необходимо знать, кто из их пациенток входит в группу риска. Повышенный риск выкидыша наблюдается в следующих ситуациях: возраст матери старше 35 лет; возраст отца старше 53 лет; наличие генетических дефектов у одного из родителей; самопроизвольные выкидыши или рождение мертвого ребенка в анамнезе; рождение детей с врожденными аномалиями развития. Всего в исследование было включено 146 беременных женщин с кровотечением слабой или умеренной интенсивности. Пациентки были разделены на две группы методом случайной выборки. В одной группе в дополнение к стандартному лечению женщины получали Дюфастон (дидрогестерон) по 10 мг два раза в сутки. Вторая группа была контрольной. Лечение препаратом прекращали спустя 1 неделю после остановки кровотечения. Лечение отменяли при увеличении интенсивности кровотечения, признаках выделения содержимого плодной оболочки, повышении температуры тела, отсутствии признаков роста плодного пузыря через неделю наблюдения, недостаточно выраженном или отсутствующем полюсе плода при размере плодного пузыря 25 мм и более или отсутствии сердечной активности.
По мнению автора, до начала лечения следует установить причину кровотечения. Необходимо знать, кто из их пациенток входит в группу риска. Повышенный риск выкидыша наблюдается в следующих ситуациях: возраст матери старше 35 лет; возраст отца старше 53 лет; наличие генетических дефектов у одного из родителей; самопроизвольные выкидыши или рождение мертвого ребенка в анамнезе; рождение детей с врожденными аномалиями развития. Всего в исследование было включено 146 беременных женщин с кровотечением слабой или умеренной интенсивности. Пациентки были разделены на две группы методом случайной выборки. В одной группе в дополнение к стандартному лечению женщины получали Дюфастон (дидрогестерон) по 10 мг два раза в сутки. Вторая группа была контрольной. Лечение препаратом прекращали спустя 1 неделю после остановки кровотечения. Лечение отменяли при увеличении интенсивности кровотечения, признаках выделения содержимого плодной оболочки, повышении температуры тела, отсутствии признаков роста плодного пузыря через неделю наблюдения, недостаточно выраженном или отсутствующем полюсе плода при размере плодного пузыря 25 мм и более или отсутствии сердечной активности. Частота абортов достоверно снизилась (р<0,05) в группе женщин, получавших Дюфастон, по сравнению с контрольной группой. Беременность завершилась своевременным родоразрешением у 75% испытуемых в группе принимавших Дюфастон и у 66,6% в контрольной группе. Частота осложнений беременности, включая преэклампсию, задержку внутриутробного роста плода, кровотечение или появление врожденных аномалий развития, была практически одинаковой в обеих группах.
Частота абортов достоверно снизилась (р<0,05) в группе женщин, получавших Дюфастон, по сравнению с контрольной группой. Беременность завершилась своевременным родоразрешением у 75% испытуемых в группе принимавших Дюфастон и у 66,6% в контрольной группе. Частота осложнений беременности, включая преэклампсию, задержку внутриутробного роста плода, кровотечение или появление врожденных аномалий развития, была практически одинаковой в обеих группах.
На Х Всемирном Конгрессе по гинекологической эндокринологии в г. Вроцлав (Польша) A.R. Genazzani [10] выступил с обзором предыдущих исследований, в которых для лечения привычного выкидыша и угрожающего аборта применяли Дюфастон. Докладчик привел следующую статистику. Согласно опубликованным отчетам в исследованиях приняли участие 339 женщин. У 275 (81%) беременность успешно завершилась родоразрешением, выкидыш имел место у 64 женщин (19%).
19 из 64 выкидышей случились в течение 48 часов с момента начала терапии, что указывает на то, что прерывание беременности произошло еще до начала лечения. В 8 из 64 случаев причина выкидыша была известна. По мнению A.R. Genazzani, эти данные свидетельствуют об очевидном положительном эффекте терапии. Оценивая эффективность применения Дюфастона во время беременности, автор указывает на то, что препарат оказывает благоприятное действие при угрожающем аборте и привычном выкидыше. Что касается риска при приеме Дюфастона, то он показал себя как исключительно безопасный препарат и отлично переносится пациентками. Согласно данным статистики в мире живет 7 миллионов человек, испытавших действие препарата в утробе матери, при этом признаков тератогенного действия препарата не отмечено.
В 8 из 64 случаев причина выкидыша была известна. По мнению A.R. Genazzani, эти данные свидетельствуют об очевидном положительном эффекте терапии. Оценивая эффективность применения Дюфастона во время беременности, автор указывает на то, что препарат оказывает благоприятное действие при угрожающем аборте и привычном выкидыше. Что касается риска при приеме Дюфастона, то он показал себя как исключительно безопасный препарат и отлично переносится пациентками. Согласно данным статистики в мире живет 7 миллионов человек, испытавших действие препарата в утробе матери, при этом признаков тератогенного действия препарата не отмечено.
З.С. Зайдиева и соавт. [7] провели анализ исходной клинической характеристики, особенностей течения I триместра беременности у 97 женщин с высоким инфекционным риском и отягощенным акушерским анамнезом. Группа I – 52 женщины группы высокого инфекционного риска, получавшие Дюфастон в 3–х менструальных циклах до планируемой беременности в дозе 10 мг 2 раза в сутки, группа II – 45 женщин группы высокого инфекционного риска, получавшие с первых недель гестации Дюфастон. Полученные авторами данные свидетельствуют, что по течению беременности в I триместре гестации у пациенток группы II достоверно чаще встречались ранний токсикоз и угроза прерывания беременности. При ультразвуковом исследовании хорионит и отслойка хориона достоверно чаще отмечались в группе женщин, не получавших терапию Дюфастоном. На основании проведенного анализа авторы показали, что назначение гестагенной поддержки является необходимым компонентом терапии, направленной на подготовку к беременности и ее успешное пролонгирование у женщин с инфекционной патологией и отягощенным акушерским и репродуктивным анамнезом.
Полученные авторами данные свидетельствуют, что по течению беременности в I триместре гестации у пациенток группы II достоверно чаще встречались ранний токсикоз и угроза прерывания беременности. При ультразвуковом исследовании хорионит и отслойка хориона достоверно чаще отмечались в группе женщин, не получавших терапию Дюфастоном. На основании проведенного анализа авторы показали, что назначение гестагенной поддержки является необходимым компонентом терапии, направленной на подготовку к беременности и ее успешное пролонгирование у женщин с инфекционной патологией и отягощенным акушерским и репродуктивным анамнезом.
О.Ф. Серовой [4] проведено изучение терапевтической эффективности Дюфастона при угрожающем прерывании беременности в I триместре. Проведено обследование 54 пациенток с помощью общеклинических, радиоиммунологического и ультразвукового методов исследования. Автор показала, что применение Дюфастона способствует быстрому улучшению самочувствия больных, нормализации функции фетоплацентарного комплекса и кровотока в яичниковых и маточных артериях.
Вышеизложенное показывает, что терапию гестагенными препаратами необходимо начинать при подготовке к беременности, а при ее наступлении – не дожидаясь развития клинических признаков осложненного течения процесса гестации. Назначение данной группы препаратов с первых недель гестации, особенно у женщин, не прошедших подготовки к наступлению беременности, позволяет значительно снизить риск развития таких осложнений, как угроза прерывания, хорионит, отслойка хориона, самопроизвольное прерывание беременности на ранних сроках и т.д. Полноценная терапия в I триместре гестации способствует адекватному формированию фето–плацентарной системы и позволит в дальнейшем избежать таких осложнений, как плацентарная недостаточность, задержка внутриутробного развития плода, внутриутробная инфекция и т.д. Все вышеизложенное найдет свое отражение в улучшении акушерских и перинатальных исходов.
Литература
1. Демидова Е.М. Привычный выкидыш (патогенез, акушерская тактика): Дисс. … докт. мед. наук.– М.–1993.
… докт. мед. наук.– М.–1993.
2. Зайдиева З.С., Прозоров В.В., Карапетян Т.Э. Прогестероновая поддержка при планировании беременности у женщин с высоким инфекционным риском. // Русский медицинский журнал.–2006.– Т.11, № 1.– С.25–28.
3. Кулаков В.И., Орджоникидзе Н.В., Тютюнник В.Л. Плацентарная недостаточность и инфекция. М.: 2004.– 494с.
4. Серова О.Ф. Опыт применения дюфастона для лечения женщин с угрожающим прерыванием беременности в I триместре. // Вестник Российской ассоциации акушеров–гинекологов.–2000.– № 3. С.1–2
5. Сидельникова В.М. Привычная потеря беременности.– М.; Триада–Х, 2002.– 304с.
6. Сухих Г.Т., Ванько Л.В. Иммунология беременности. // М.: Издательство РАМН, 2003.– 400с.
7. Bick R.L., Madden J., Heller K.B., Toofanian A. Recurrent miscarriage: causes, evaluation, and treatment. // Medscape Women`s Health.–1998.– Vol. 3, № 3.– P.2–13.
8. Choi В.С., Polgar K., Xiao L. et al. Progesterone inhibits in–vitro embryotoxic Th2 cytokine production to trophoblast in women with recurrent pregnancy loss. // Hum. Reprod.–2000.– Vol.15.– P.46–59.
// Hum. Reprod.–2000.– Vol.15.– P.46–59.
9. El–Zibdeh M.Y. Randomized study comparing the efficacy of reducing spontaneous abortion following treatment with a dydrogesterone and human chorionic gonadotrophin (hCG).–Fertil. Steril.–1998.– Vol.70.– P.77–78.
10. Genazzani A.R Hormone replacement therapy: the perspectives for the 21st century. // Maturitas.–1999.– Vol.31–32, 1.– P.11–17.
11. Klentzeris L.D. The role of endometrium in implantation. // Hum. Reprod.–1997.– Vol. 12.– P.170–175.
12. Simoncini T., Caruso A., Giretti M.S. et al. Effects of dydrogesterone and of its stable metabolite, 20–alpha–dihydrodydrogesterone, on nitric oxide syntesis in human endothelial cells. // Fertil. Steril.–2006.– Vol.37.– P.777–787.
13. Szekeres–Bartho J., Faust Z., Varga P. et al. The immunological pregnancy protective effect of progesterone is manifested via controlling cytokine production. // Am. J. Reprod. Immunol.–1996.–Vol. 35, № 4.– P.348–351.
14. Szekeres–Bartho J. Progesterone receptor–mediated immunomodulation and anti–abortive effects: The role of PIBF. // Ginecologycal Endocrinology.–2001.– Vol.15, № 5.– P.43–47.
Szekeres–Bartho J. Progesterone receptor–mediated immunomodulation and anti–abortive effects: The role of PIBF. // Ginecologycal Endocrinology.–2001.– Vol.15, № 5.– P.43–47.
Эффективность, безопасность и рецидив новых прогестинов и селективных модуляторов рецепторов прогестерона для лечения эндометриоза: сравнительное исследование на мышах
1. Garcia-Velasco JA, Somigliana E. Лечение эндометриом у женщин, нуждающихся в ЭКО: трогать или не трогать. Хум Репрод. 2009; 24: 496–501. doi: 10.1093/humrep/den398. [PubMed] [CrossRef] [Google Scholar]
2. Meuleman C, Vandenabeele B, Fieuws S, Spiessens C, Timmerman D, D’Hooghe T. Высокая распространенность эндометриоза у бесплодных женщин с нормальной овуляцией и нормоспермическими партнерами. Фертил Стерил. 2009 г.;92:68–74. doi: 10.1016/j.fertnstert.2008.04.056. [PubMed] [CrossRef] [Google Scholar]
3. Китаваки Дж., Кадо Н., Исихара Х., Косиба Х., Китаока Ю., Хондзё Х. Эндометриоз: патофизиология как эстроген-зависимое заболевание. J Steroid Biochem Mol Biol. 2002; 83: 149–155. doi: 10.1016/S0960-0760(02)00260-1. [PubMed] [CrossRef] [Google Scholar]
J Steroid Biochem Mol Biol. 2002; 83: 149–155. doi: 10.1016/S0960-0760(02)00260-1. [PubMed] [CrossRef] [Google Scholar]
4. Sampson JA. Перитонеальный эндометриоз из-за менструальной диссеминации ткани эндометрия в брюшную полость. Am J Obstet Gynecol. 1927;14:422–469. doi: 10.1016/S0002-9378(15)30003-X. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Zeitoun K, Takayama K, Sasano H, Suzuki T, Moghrabi N, Andersson S, Johns A, Meng L, Putman M, Carr B, Bulun ЮВ. Недостаточная экспрессия 17бета-гидроксистероиддегидрогеназы 2 типа при эндометриозе: неспособность метаболизировать 17бета-эстрадиол. J Clin Endocrinol Metab. 1998; 83: 4474–4480. [PubMed] [Google Scholar]
6. Ван дер Линден П.Дж. Теории патогенеза эндометриоза. Human Reprod (Оксфорд, Англия) 1996; 11 (Прил. 3): 53–65. doi: 10.1093/humrep/11.suppl_3.53. [PubMed] [CrossRef] [Google Scholar]
7. Olive DL, Pritts EA. Лечение эндометриоза. N Engl J Med. 2001; 345: 266–275. doi: 10.1056/NEJM200107263450407. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
8. Fuldeore MJ, Soliman AM. Распространенность и симптоматическое бремя диагностированного эндометриоза в Соединенных Штатах: национальные оценки на основе поперечного обследования 59 411 женщин. Gynecol Obstet Investig. 2016; [PubMed]
9. Де Грааф А.А., Д’Хуге Т.М., Г.Дж. Д., Дирксен К.Д., Хуммельшой Л., Симоенс С., Бокор А., Брандес И., Бродски В., Канис М. и соавт. Значительное влияние эндометриоза на физическое, психическое и социальное благополучие: результаты международного перекрестного исследования. Хум Репрод. 2013;28:2677–2685. doi: 10.1093/humrep/det284. [PubMed] [CrossRef] [Google Scholar]
10. Fagervold B, Jenssen M, Hummelshoj L, Moen MH. Жизнь после диагноза эндометриоз — 15-летнее наблюдение. Acta Obstet Gynecol Scand. 2009 г.;88:914–919. doi: 10.1080/00016340903108308. [PubMed] [CrossRef] [Google Scholar]
11. Dunselman GaJ, Vermeulen N, Becker C, Calhaz-Jorge C, D’Hooghe T, De Bie B, Heikinheimo O, Horne AW, Kiesel L, Nap A, et al: Руководство ESHRE: ведение женщин с эндометриозом. Hum Reprod 2014, 29: 400–412. [PubMed]
Hum Reprod 2014, 29: 400–412. [PubMed]
12. Бейтман Дж., Буги О., Сингх С., Ислам С. Гистоморфологические изменения эндометриоза у пациентки, получавшей улипристал: клинический случай. Патол Res Pract. 2017;213:79–81. doi: 10.1016/j.prp.2016.10.010. [PubMed] [CrossRef] [Google Scholar]
13. Cornillie FJ, Puttemans P, Brosens IA. Гистология и ультраструктура эндометриоидных тканей человека, получавших дидрогестерон (Дюфастон) Eur J Obstet Gynecol Reprod Biol. 1987; 26: 39–55. doi: 10.1016/0028-2243(87)
-6. [PubMed] [CrossRef] [Google Scholar]
14. Schindler AE, Henkel A, Moore C, Oettel M. Эффект и безопасность высоких доз диеногеста (20 мг/день) при лечении женщин с эндометриозом. Arch Gynecol Obstet. 2009 г.;282:507–514. doi: 10.1007/s00404-009-1301-z. [PubMed] [CrossRef] [Google Scholar]
15. Доннез Дж., Татарчук Т.Ф., Бушар П., Пушкашу Л., Захаренко Н.Ф., Иванова Т., Угочай Г., Мара М., Джилла М.П., Бестел Э. и др. Улипристала ацетат по сравнению с плацебо для лечения миомы перед операцией. N Engl J Med. 2012; 366: 409–420. doi: 10.1056/NEJMoa1103182. [PubMed] [CrossRef] [Google Scholar]
N Engl J Med. 2012; 366: 409–420. doi: 10.1056/NEJMoa1103182. [PubMed] [CrossRef] [Google Scholar]
16. Courtoy GE, Donnez J, Marbaix E, Dolmans MM. In vivo механизмы уменьшения объема миомы матки при лечении улипристала ацетатом. Фертил Стерил. 2015; 104: 426–434. doi: 10.1016/j.fertnstert.2015.04.025. [PubMed] [CrossRef] [Академия Google]
17. Esber N, Le Billan F, Resche-Rigon M, Loosfelt H, Lombès M, Chabbert-Buffet N. Улипристала ацетат ингибирует опосредованную изоформой A рецептора прогестерона пролиферацию рака молочной железы человека и экспрессию BCl2-L1. ПЛОС Один. 2015;10:e0140795. doi: 10.1371/journal.pone.0140795. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Мансур Д. Использование новых прогестагенов в контрацепции и гинекологии. Акушерство Гинекол. 2006; 8: 229–234. [Google Scholar]
19. Overton CE, Lindsay PC, Johal B, Collins SA, Siddle NC, Shaw RW, Barlow DH. Рандомизированное двойное слепое плацебо-контролируемое исследование дидрогестерона лютеиновой фазы (Дюфастона) у женщин с минимальным или легким эндометриозом. Фертил Стерил. 1994;62:701–707. doi: 10.1016/S0015-0282(16)56991-X. [PubMed] [CrossRef] [Google Scholar]
Фертил Стерил. 1994;62:701–707. doi: 10.1016/S0015-0282(16)56991-X. [PubMed] [CrossRef] [Google Scholar]
20. Каспер РФ. Таблетки, содержащие только прогестин, могут быть лучшим средством первой линии лечения эндометриоза, чем комбинированные эстроген-гестагенные противозачаточные таблетки. Фертил Стерил. 2017; 107: 533–536. doi: 10.1016/j.fertnstert.2017.01.003. [PubMed] [CrossRef] [Google Scholar]
21. Верчеллини П., Кортези И., Крозиньяни П.Г. Прогестины при симптоматическом эндометриозе: критический анализ доказательств. Фертил Стерил. 1997;68:393–401. doi: 10.1016/S0015-0282(97)00193-3. [PubMed] [CrossRef] [Google Scholar]
22. Okada H, Nakajima T, Yoshimura T, Yasuda K, Kanzaki H. Ингибирующее действие диеногеста, синтетического стероида, на рост стромальных клеток эндометрия человека in vitro. Мол Хум Репрод. 2001; 7: 341–347. doi: 10.1093/моль час/7.4.341. [PubMed] [CrossRef] [Google Scholar]
23. Laschke MW, Menger MD. Антиангиогенные стратегии лечения эндометриоза. Обновление воспроизведения гула. 2012; 18: 682–702. дои: 10.1093/humupd/dms026. [PubMed] [CrossRef] [Google Scholar]
Обновление воспроизведения гула. 2012; 18: 682–702. дои: 10.1093/humupd/dms026. [PubMed] [CrossRef] [Google Scholar]
24. Макабе Т., Кога К., Мияшита М., Такеучи А., Сью Ф., Тагучи А., Урата Ю., Изуми Г., Такамура М., Харада М. и др. Дроспиренон снижает экспрессию воспалительных цитокинов, фактора роста эндотелия сосудов (VEGF) и фактора роста нервов (NGF) в эндометриоидных стромальных клетках человека. J Reprod Immunol. 2017;119:44–48. doi: 10.1016/j.jri.2016.12.002. [PubMed] [CrossRef] [Google Scholar]
25. Nakamura M, Katsuki Y, Shibutani Y, Oikawa T. Диеногест, синтетический стероид, подавляет как эмбриональный, так и индуцированный опухолевыми клетками ангиогенез. Евр Дж Фармакол. 1999;386:33–40. doi: 10.1016/S0014-2999(99)00765-7. [PubMed] [CrossRef] [Google Scholar]
26. Tsuchiya T, Katagiri Y, Maemura T, Hayata E, Fukuda Y, Kitamura M, Morita M. Предоперационный диеногест для улучшения хирургического поля зрения в резектоскопической хирургии. Gynecol Minim Invasive Ther.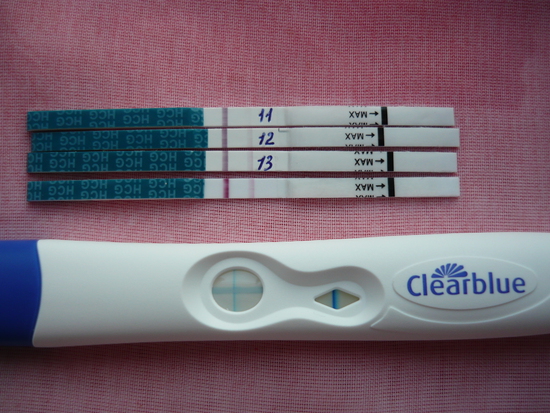 2016;5:16–19. doi: 10.1016/j.gmit.2015.01.011. [CrossRef] [Google Scholar]
2016;5:16–19. doi: 10.1016/j.gmit.2015.01.011. [CrossRef] [Google Scholar]
27. Pelch KE, Sharpe-Timms KL, Nagel SC. Мышиная модель хирургически индуцированного эндометриоза путем аутотрансплантации ткани матки. J Vis Exp. 2012: е3396. [Бесплатная статья PMC] [PubMed]
28. Bacci M, Capobianco A, Monno A, Cottone L, Di Puppo F, Camisa B, Mariani M, Brignole C, Ponzoni M, Ferrari S, et al. Макрофаги альтернативно активируются у пациентов с эндометриозом и необходимы для роста и васкуляризации поражений в мышиной модели заболевания. Ам Джей Патол. 2009; 175: 547–556. doi: 10.2353/ajpath.2009.081011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Аоки Д., Кацуки Ю., Симидзу А., Какинума С., Нодзава С. Успешная гетеротрансплантация человеческого эндометрия мышам SCID. Акушерство Гинекол. 1994;83:220–228. [PubMed] [Google Scholar]
30. Wang CC, Xu H, GCW M, Zhang T, Chu KO, Chu CY, JTY C, Li G, He YX, Qin L, et al. Пролекарство эпигаллокатехин-3-галлата зеленого чая (про-EGCG) в качестве мощного средства против ангиогенеза при эндометриозе у мышей. Ангиогенез. 2013;16:59–69. doi: 10.1007/s10456-012-9299-4. [PubMed] [CrossRef] [Google Scholar]
Ангиогенез. 2013;16:59–69. doi: 10.1007/s10456-012-9299-4. [PubMed] [CrossRef] [Google Scholar]
31. Xu H, Lui WT, Chu CY, Ng PS, Wang CC, Rogers MS. Антиангиогенные эффекты катехина зеленого чая на экспериментальной мышиной модели эндометриоза. Хум Репрод. 2009 г.;24:608–618. doi: 10.1093/humrep/den417. [PubMed] [CrossRef] [Google Scholar]
32. Роквилл. Центр оценки и исследования лекарственных средств (CDER), 2005 г. Руководство для промышленности: оценка максимальной безопасной начальной дозы в первоначальных клинических испытаниях терапевтических средств на взрослых здоровых добровольцах. [Google Scholar]
33. Oliveira CR, Salvatori R, Nobrega LM, Carvalho EO, Menezes M, Farias CT, Britto AV, Pereira RM, Aguiar-Oliveira MH. Размеры органов брюшной полости у взрослых с тяжелой формой низкого роста из-за тяжелого, нелеченного врожденного дефицита гормона роста, вызванного гомозиготной мутацией в гене рецептора GHRH. Клин Эндокринол. 2008;69: 153–158. doi: 10.1111/j. 1365-2265.2007.03148.x. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
1365-2265.2007.03148.x. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
34. Cardiff RD, Miller CH, Munn RJ: Ручное окрашивание гематоксилином и эозином срезов тканей мыши. Протокол Cold Spring Harb 2014, 2014: pdb.prot073411. [PubMed]
35. Кахари В.М., Саариалхо-Кере У. Матриксные металлопротеиназы и их ингибиторы при росте и инвазии опухоли. Энн Мед. 1999; 31:34–45. doi: 10.3109/0785389990
60. [PubMed] [CrossRef] [Академия Google]
36. Раббани С.А. Металлопротеазы и урокиназы в ангиогенезе и опухолевой прогрессии. В Виво. 1998; 12: 135–142. [PubMed] [Google Scholar]
37. Шеппард Д. Опосредованная интегрином активация латентного трансформирующего фактора роста бета. Метастазы рака, ред. 2005; 24:395–402. doi: 10.1007/s10555-005-5131-6. [PubMed] [CrossRef] [Google Scholar]
38. Sivridis E, Giatromanolaki A, Gatter KC, Harris AL, Koukourakis MI, for the T, Angiogenesis Research G Ассоциация индуцируемых гипоксией факторов 1α и 2α с активированными ангиогенными путями и прогноз при раке эндометрия. Рак. 2002;95:1055–1063. doi: 10.1002/cncr.10774. [PubMed] [CrossRef] [Google Scholar]
Рак. 2002;95:1055–1063. doi: 10.1002/cncr.10774. [PubMed] [CrossRef] [Google Scholar]
39. Goteri G, Lucarini G, Montik N, Zizzi A, Stramazzotti D, Fabris G, Tranquilli AL, Ciavattini A. Экспрессия фактора роста эндотелия сосудов (VEGF), индуцируемая гипоксией фактор-1альфа (HIF-1альфа) и плотность микрососудов в ткани эндометрия у женщин с аденомиозом. Int J Gynecol Pathol. 2009; 28: 157–163. doi: 10.1097/PGP.0b013e318182c2be. [PubMed] [CrossRef] [Google Scholar]
40. Joyce D, Albanese C, Steer J, Fu M, Bouzahzah B, Pestell RG. NF-kappaB и регуляция клеточного цикла: связь с циклином. Цитокиновый фактор роста, ред. 2001; 12:73–9.0. doi: 10.1016/S1359-6101(00)00018-6. [PubMed] [CrossRef] [Google Scholar]
41. Schwartz SA, Hernandez A, Mark Evers B. Роль белков NF-kappaB/IkappaB в развитии рака: последствия для новых стратегий лечения. Сур Онкол. 1999; 8: 143–153. doi: 10.1016/S0960-7404(00)00012-8. [PubMed] [CrossRef] [Google Scholar]
42. Hall PA, Levison DA, Woods AL, Yu CC, Kellock DB, Watkins JA, Barnes DM, Gillett CE, Camplejohn R, Dover R, et al. Иммунолокализация ядерного антигена пролиферирующих клеток (PCNA) в парафиновых срезах: показатель пролиферации клеток с признаками нарушения регуляции экспрессии в некоторых новообразованиях. Джей Патол. 1990;162:285–294. doi: 10.1002/path.1711620403. [PubMed] [CrossRef] [Google Scholar]
Иммунолокализация ядерного антигена пролиферирующих клеток (PCNA) в парафиновых срезах: показатель пролиферации клеток с признаками нарушения регуляции экспрессии в некоторых новообразованиях. Джей Патол. 1990;162:285–294. doi: 10.1002/path.1711620403. [PubMed] [CrossRef] [Google Scholar]
43. Росси АГЗ, Соарес-младший Дж. М., Мотта Э.Л.А., Симойнс М.Дж., Оливейра-Фильо Р.М., Хайдар М.А., Родригес де Лима Г., Баракат Е.К. Вызванная метоклопрамидом гиперпролактинемия влияет на морфологию эндометрия мышей. Gynecol Obstet Investig. 2003; 54: 185–190. doi: 10.1159/000068380. [PubMed] [CrossRef] [Google Scholar]
44. Schindelin J, Rueden CT, Hiner MC, Eliceiri KW. Экосистема ImageJ: открытая платформа для биомедицинского анализа изображений. Мол Репрод Дев. 2015; 82: 518–529. doi: 10.1002/mrd.22489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Durlinger ALL, Gruijters MJG, Kramer P, Karels B, Kumar TR, Matzuk MM, Rose UM, de Jong FH, Uilenbroek JTJ, Grootegoed JA, Теммен АПН. Антимюллеровский гормон ослабляет действие ФСГ на развитие фолликулов в яичниках мышей. Эндокринология. 2001; 142:4891–4899. doi: 10.1210/эндо.142.11.8486. [PubMed] [CrossRef] [Google Scholar]
Антимюллеровский гормон ослабляет действие ФСГ на развитие фолликулов в яичниках мышей. Эндокринология. 2001; 142:4891–4899. doi: 10.1210/эндо.142.11.8486. [PubMed] [CrossRef] [Google Scholar]
46. Myers M, Britt KL, Wreford NGM, Ebling FJP, Kerr JB. Методы количественного определения числа фолликулов в яичнике мыши. Репродукция. 2004;127:569–580. doi: 10.1530/реп.1.00095. [PubMed] [CrossRef] [Google Scholar]
47. Ray A, Dittel BN. Выделение клеток брюшной полости мыши. J Vis Exp. 2010:е1488. [Бесплатная статья PMC] [PubMed]
48. Grzechocinska B, Gadomska H, Zygula A, Wielgos M. Применение улипристала ацетата у пациенток с миомой матки. Нейроэндокринол Летт. 2014; 35: 175–178. [PubMed] [Google Scholar]
49. Brache V, Cochon L, Deniaud M, Croxatto HB. Улипристала ацетат предотвращает овуляцию более эффективно, чем левоноргестрел: анализ объединенных данных трех рандомизированных исследований схем экстренной контрацепции. Контрацепция. 2013; 88: 611–618. doi: 10.1016/j.contraception.2013.05.010. [PubMed] [CrossRef] [Академия Google]
doi: 10.1016/j.contraception.2013.05.010. [PubMed] [CrossRef] [Академия Google]
50. Huniadi CA, Pop OL, Antal TA, Stamatian F. Влияние улипристала на экспрессию Bax/Bcl-2, цитохрома C, Ki-67 и циклооксигеназы-2 в модели крыс с эндометриозом, индуцированным хирургическим путем. Eur J Obstet Gynecol Reprod Biol. 2013; 169: 360–365. doi: 10.1016/j.ejogrb.2013.03.022. [PubMed] [CrossRef] [Google Scholar]
51. Rossé T, Olivier R, Monney L, Rager M, Conus S, Fellay I, Jansen B, Borner C. Bcl-2 продлевает выживание клеток после индуцированного Bax высвобождения цитохром в. Природа. 1998;391:496–499. дои: 10.1038/35160. [PubMed] [CrossRef] [Google Scholar]
52. Йошино О., Осуга Ю., Хирота Ю., Кога К., Хирата Т., Харада М., Моримото С., Яно Т., Ниши О., Цуцуми О., Такетани Ю. Возможные патофизиологические роли митоген-активируемых протеинкиназ (МАРК) при эндометриозе. Am J Reprod Immunol. 2004; 52:306–311. doi: 10.1111/j.1600-0897.2004.00231.x. [PubMed] [CrossRef] [Google Scholar]
53. Шульце-Остхофф К., Феррари Д., Рихеманн К., Вессельборг С. Регуляция активации NF-каппа B каскадами киназ MAP. Иммунобиология. 1997;198:35–49. doi: 10.1016/S0171-2985(97)80025-3. [PubMed] [CrossRef] [Google Scholar]
Шульце-Остхофф К., Феррари Д., Рихеманн К., Вессельборг С. Регуляция активации NF-каппа B каскадами киназ MAP. Иммунобиология. 1997;198:35–49. doi: 10.1016/S0171-2985(97)80025-3. [PubMed] [CrossRef] [Google Scholar]
54. Wada T, Penninger JM. Митоген-активируемые протеинкиназы в регуляции апоптоза. Онкоген. 2004; 23: 2838–2849. doi: 10.1038/sj.onc.1207556. [PubMed] [CrossRef] [Google Scholar]
55. Moldovan GL, Pfander B, Jentsch S. PCNA, маэстро вилки репликации. Клетка. 2007; 129: 665–679. doi: 10.1016/j.cell.2007.05.003. [PubMed] [CrossRef] [Google Scholar]
56. Scholzen T, Gerdes J. Белок Ki-67: от известного и неизвестного. J Cell Physiol. 2000; 182:311–322. doi: 10.1002/(SICI)1097-4652(200003)182:3<311::AID-JCP1>3.0.CO;2-9. [PubMed] [CrossRef] [Google Scholar]
57. Ylänen K, Laatikainen T, Lähteenmäki P, Moo-Young AJ. Подкожный прогестиновый имплантат (Нестороне®) при лечении эндометриоза: клинический ответ на различные дозы. Acta Obstet Gynecol Scand. 2003; 82: 167–172. [PubMed] [Google Scholar]
2003; 82: 167–172. [PubMed] [Google Scholar]
58. Donnez J, Hudecek R, Donnez O, Matule D, Arhendt HJ, Zatik J, Kasilovskiene Z, Dumitrascu MC, Fernandez H, Barlow DH, et al. Эффективность и безопасность многократного применения улипристала ацетата при миоме матки. Фертил Стерил. 2015;103:519–527. doi: 10.1016/j.fertnstert.2014.10.038. [PubMed] [CrossRef] [Google Scholar]
59. Ким С.А., Ум М.Дж., Ким Х.К., Ким С.Дж., Мун С.Дж., Юнг Х. Исследование диеногеста при дисменорее и тазовой боли, связанной с эндометриозом. Акушерство Gynecol Sci. 2016; 59: 506–511. doi: 10.5468/ogs.2016.59.6.506. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
60. Strowitzki T, Marr J, Gerlinger C, Faustmann T, Seitz C. Диеногест столь же эффективен, как и ацетат лейпролида, при лечении болезненных симптомов эндометриоза: 24-недельное рандомизированное многоцентровое открытое исследование. Хум Репрод. 2010;25:633–641. дои: 10.1093/хумреп/деп469. [PubMed] [CrossRef] [Google Scholar]
61. Berlanda N, Somigliana E, Frattaruolo MP, Buggio L, Dridi D, Vercellini P. Хирургия или гормональная терапия при глубоком эндометриозе: выбор врача? Eur J Obstet Gynecol Reprod Biol. 2017;209:67–71. doi: 10.1016/j.ejogrb.2016.07.513. [PubMed] [CrossRef] [Google Scholar]
Berlanda N, Somigliana E, Frattaruolo MP, Buggio L, Dridi D, Vercellini P. Хирургия или гормональная терапия при глубоком эндометриозе: выбор врача? Eur J Obstet Gynecol Reprod Biol. 2017;209:67–71. doi: 10.1016/j.ejogrb.2016.07.513. [PubMed] [CrossRef] [Google Scholar]
62. Chwalisz K, Perez MC, Demanno D, Winkel C, Schubert G, Elger W. Разработка и использование селективных модуляторов рецепторов прогестерона в лечении лейомиомы и эндометриоза. Endocr Rev. 2005; 26:423–438. doi: 10.1210/er.2005-0001. [PubMed] [CrossRef] [Академия Google]
63. Арендас К., Лейланд Н.А. Использование улипристала ацетата для лечения острого аномального маточного кровотечения, связанного с миомой. J Obstet Gynaecol Can. 2016;38:80–83. doi: 10.1016/j.jogc.2015.11.005. [PubMed] [CrossRef] [Google Scholar]
64. Матыцина-Куинлан Л., Матыцина Л. Аномальное чрезмерное кровотечение из влагалища (PV) при применении селективного модулятора рецептора прогестерона (SPRM) Эсмия у пациентки с симптомами миомы матки. BMJ Case Rep. 2015; 2015:bcr2014209015. doi: 10.1136/bcr-2014-209015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
BMJ Case Rep. 2015; 2015:bcr2014209015. doi: 10.1136/bcr-2014-209015. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Nagata C, Yanagida S, Okamoto A, Morikawa A, Sugimoto K, Okamoto S, Ochiai K, Tanaka T. Факторы риска прекращения лечения в связи с маточными кровотечениями у пациенток с аденомиозом, получавших диеногест. J Obstet Gynaecol Res. 2012; 38: 639–644. doi: 10.1111/j.1447-0756.2011.01778.x. [PubMed] [CrossRef] [Google Scholar]
66. Micks EA, Jensen JT. Лечение обильных менструальных кровотечений с помощью пероральных противозачаточных таблеток эстрадиола валерата и диеногеста. Adv Ther. 2013; 30:1–13. doi: 10.1007/s12325-012-0071-3. [PubMed] [CrossRef] [Академия Google]
67. Уитакер Л.Х.Р., Мюррей А.А., Мэтьюз Р., Шоу Г., Уильямс А.Р.В., Сондерс П.Т.К., Кричли ХОД. Селективный модулятор рецепторов прогестерона (СМРП) улипристала ацетат (УПА) и его влияние на эндометрий человека. Хум Репрод. 2017; 32: 531–543. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Jesam C, Cochon L, Salvatierra AM, Williams A, Kapp N, Levy-Gompel D, Brache V. Проспективное открытое многоцентровое исследование для оценки Фармакодинамика и безопасность повторного применения 30 мг улипристала ацетата. Контрацепция. 2016;93: 310–316. doi: 10.1016/j.contraception.2015.12.015. [PubMed] [CrossRef] [Google Scholar]
Jesam C, Cochon L, Salvatierra AM, Williams A, Kapp N, Levy-Gompel D, Brache V. Проспективное открытое многоцентровое исследование для оценки Фармакодинамика и безопасность повторного применения 30 мг улипристала ацетата. Контрацепция. 2016;93: 310–316. doi: 10.1016/j.contraception.2015.12.015. [PubMed] [CrossRef] [Google Scholar]
69. Nakamura S, Douchi T, Oki T, Ijuin H, Yamamoto S, Nagata Y. Взаимосвязь между сонографической толщиной эндометрия и кровотечением отмены, вызванным прогестином. Акушерство Гинекол. 1996; 87: 722–725. doi: 10.1016/0029-7844(96)00016-6. [PubMed] [CrossRef] [Google Scholar]
70. Bergeron C, Fox H. Низкая частота гиперплазии эндометрия с приемлемым характером кровотечения у женщин, получающих последовательную заместительную гормональную терапию дидрогестероном. Гинекол Эндокринол. 2000; 14: 275–281. дои: 10.3109/095135
167694. [PubMed] [CrossRef] [Google Scholar]
71. Quereux C, Pornel B, Bergeron C, Ferenczy A. Непрерывная комбинированная заместительная гормональная терапия с 1 мг 17β-эстрадиола и 5 мг дидрогестерона (Фемостон®-конти): безопасность эндометрия и профиль кровотечения. Зрелые. 2006; 53: 299–305. doi: 10.1016/j.maturitas.2005.05.015. [PubMed] [CrossRef] [Google Scholar]
Зрелые. 2006; 53: 299–305. doi: 10.1016/j.maturitas.2005.05.015. [PubMed] [CrossRef] [Google Scholar]
72. Кодама М., Оноуэ М., Оцука Х., Яда-Хашимото Н., Саэки Н., Кодама Т., Вакаса Т., Фунато Т. Эффективность диеногеста при истончении эндометрия перед гистероскопической операцией . J Миним инвазивный гинекол. 2013;20:790–795. doi: 10.1016/j.jmig.2013.04.020. [PubMed] [CrossRef] [Google Scholar]
73. Laganà AS, Vitale SG, Muscia V, Rossetti P, Buscema M, Triolo O, Rapisarda AMC, Giunta L, Palmara V, Granese R, et al. Подготовка эндометрия диеногестом перед гистероскопической операцией: систематический обзор. Arch Gynecol Obstet. 2017; 295:661–667. doi: 10.1007/s00404-016-4244-1. [PubMed] [CrossRef] [Google Scholar]
74. Klipping C, Duijkers I, Remmers A, Faustmann T, Zurth C, Klein S, Schuett B. Ингибирующие овуляцию эффекты диеногеста в рандомизированном фармакодинамическом исследовании с контролируемой дозой здоровых женщин. Дж. Клин Фармакол. 2012; 52:1704–1713. дои: 10.1177/0091270011423664. [PubMed] [CrossRef] [Google Scholar]
дои: 10.1177/0091270011423664. [PubMed] [CrossRef] [Google Scholar]
75. Claassen V, Morsink L, de Wachter AM. Влияние дидрогестерона (6-дегидроретропрогестерона, дюфастона) на овуляцию у крыс, кроликов и обезьян. Акта Эндокринол. 1971; 67: 551–562. [PubMed] [Google Scholar]
76. Endrikat J, Parke S, Trummer D, Serrani M, Duijkers I, Klipping C. Гипофиз, яичники и дополнительные противозачаточные эффекты комбинированного орального контрацептива на основе эстрадиола: результаты рандомизированного, открытое исследование. Контрацепция. 2013; 87: 227–234. doi: 10.1016/j.contraception.2012.07.008. [PubMed] [CrossRef] [Академия Google]
77. Брач В., Кошон Л., Джесам С., Мальдонадо Р., Сальватьерра А.М., Леви Д.П., Гейнер Э., Кроксатто Х.Б. Немедленное преовуляторное введение 30 мг улипристала ацетата значительно задерживает разрыв фолликула. Хум Репрод. 2010;25:2256–2263. doi: 10.1093/humrep/deq157. [PubMed] [CrossRef] [Google Scholar]
78. Guo SW. Рецидив эндометриоза и борьба с ним. Обновление воспроизведения гула. 2009; 15:441–461. doi: 10.1093/humupd/dmp007. [PubMed] [CrossRef] [Google Scholar]
Обновление воспроизведения гула. 2009; 15:441–461. doi: 10.1093/humupd/dmp007. [PubMed] [CrossRef] [Google Scholar]
79. Signorile PG, Baldi A. Новые данные об эндометриозе. Int J Biochem Cell Biol. 2015;60:19–22. doi: 10.1016/j.biocel.2014.12.019. [PubMed] [CrossRef] [Google Scholar]
Наличие эндометриоза. Можно ли использовать Витекс с Дюфастоном для зачатия?
Наличие эндометриоза. Можно ли использовать Витекс с Дюфастоном для зачатия?
Пресс
Введите
искать
iCliniq
/
Ответы
/
Акушерство и Гинекология
/
Эндометриоз
/
Наличие эндометриоза. Можно ли использовать Витекс с Дюфастоном для зачатия?
Ответил
Доктор Балакришнан. Р
и с медицинской точки зрения
проверено командой медицинского обзора iCliniq
.
Это премиальных вопросов и ответов , опубликованных 14 мая 2018 г. и последний раз рассмотренных: 25 ноября 2022 г.
Вопрос пациента
Привет, доктор,
У меня эндометриоз, поэтому врач прописал мне Дюфастон 10 мг один раз в день. Но у меня нет овуляции, и я пытаюсь забеременеть. Можно ли вместе с ним использовать Витекс 20 мг?
Ответил доктор Балакришнан. р
#
Привет,
Добро пожаловать на icliniq.com.
Как дела? Позвольте мне начать с того, что я расскажу вам несколько основных фактов об эндометриозе.
Каждый месяц, когда у женщины менструация, большая часть крови выходит через шейку матки, но небольшая часть поступает в брюшную полость через маточные трубы. Эта кровь оседает на яичниках и матке и вокруг них.
Эта кровь постепенно образует множество спаек и вызывает симптомы боли во время менструации и секса, когда спайки растягиваются. Это прогрессирующее состояние, и с каждым месяцем эта боль и спайки увеличиваются.
Теперь вы можете представить, что такое решение, остановки периодов. Для вас лучший метод — это беременность. У вас будет 10 месяцев без менструаций, а затем без менструаций, пока вы не прекратите кормить грудью.
Для вас лучший метод — это беременность. У вас будет 10 месяцев без менструаций, а затем без менструаций, пока вы не прекратите кормить грудью.
Таблетка Дюфастон – это гормон прогестерон, тот самый гормон, который вырабатывается яичниками во второй половине менструации. Это сохранит внутреннюю оболочку матки тонкой, а поскольку его принимают постоянно, это остановит гормональные взлеты и падения, необходимые для овуляции. Вот почему у вас нет овуляции. Это подходит, когда вы не ждете, чтобы забеременеть.
Я не уверен, насколько полезным будет планшет Vitex. Могу ли я предложить вам прекратить прием Дюфастона, и у вас будут менструации в течение нескольких дней. Просто пройдите следующие исследования, чтобы выяснить, есть ли какие-либо проблемы:
- Анализ спермы мужа не менее двух раз с интервалом в четыре недели. Желательно в центре бесплодия (обследование у андролога) и сахар крови.
- Ваш уровень сахара в крови и профиль щитовидной железы.
- Ультразвуковое сканирование для оценки состояния матки, яичников и придатков.

- Подтвердите проходимость маточных труб, что наиболее важно. Это трубка между маткой и яичниками (мост, где сперма встречается с яйцеклеткой и образует ребенка). Это размер волосяного фолликула, и его нельзя увидеть на снимках. Будучи такой маленькой открывающейся трубкой, ее легко заблокировать. Так что проверьтесь с помощью ГСГ (гистеросальпингограмма) или ССГ (соносальпингография) или лапароскопии.
При эндометриозе труба может закупориться, и какими бы хорошими ни были яйцеклетка и сперма, они могут вообще не встретиться. После того, как все анализы сделаны, проведите индукцию овуляции под наблюдением врача. Не оттягивайте беременность малыми методами. Ваш эндометриоз будет прогрессировать каждый месяц.
Был ли этот ответ полезен?
|
Те же симптомы не означают, что у вас такая же проблема. Обратитесь к врачу прямо сейчас!
Читайте также ответы:
- Эндометриоз
- Гистеросальпингография
- Бесплодие
- Соносальпингография
- Витекс
Комплексное второе медицинское заключение. Отправьте заявку
Отправьте заявку
Читайте также
Лихорадка денге: ответы на общие вопросы
Лихорадка денге — это самоизлечивающееся вирусное заболевание, переносимое комарами, которое нанесло огромный ущерб общественному здравоохранению. Читайте ниже… Подробнее»
Листериоз – причины, симптомы, диагностика, лечение и профилактика
Листериоз – это бактериальная инфекция, которая может привести к тяжелым осложнениям, таким как менингит, сепсис и даже смерть. R… Подробнее»
Миозит — виды, симптомы, причины, лечение и прогноз
Термин «миозит» относится к ряду необычных заболеваний. Чтобы узнать больше о миозите, прочитайте полную статью ниже. Подробнее»
Задать вопрос о здоровье врачу онлайн?
Спросите акушера-гинеколога сейчас
* гарантированный ответ в течение 4 часов.


